Spectroscopie Ultra Violet -visible
Télécharger en PDF
Principe
Interactions entre les rayonnements électromagnétiques et
les électrons des orbitales moléculaires, et plus
spécifiquement les électrons π et les paires libres.
On appelle « chromophore » les groupes fonctionnels
insaturés porteurs de tels électrons.
200 nm – 800nm
Lointain UV10 – 200nm
Proche UV 200 – 400nm
Visible 400 – 800nm
Très proche IR 800 – 1100 nm
Energie ≈ 100 Kcal
Longueur d’onde : 200 – 400 nm (U.V.) et 400 – 800
(visible)
L’absorption d’énergie est quantifiée : passage des
électrons d’orbitales de l’état fondamental vers des
orbitales d’un état excité d’énergie supérieur.
Transitions entre niveaux électroniques
E1
E2
hѵ = hc/λ
Il y a transition si ∆E = E2 – E1
L’électron passe du niveau E1 au niveau E2
Un photon a été absorbé de longueur
d’onde : λ12 = hc / ∆E
Transitions autorisées :
σ σ*
n σ*
π π*
n π*
La longueur d’onde λ dépend de la structure de
la molécule.
Caractérisation de la molécule
Les longueurs d’onde étant plus faibles qu’en IR, donc les photons
incidents sont plus énergétiques, les modifications dans les édifices
moléculaires vont être plus importantes
L’absorption moléculaire dans l’UV visible dépend de la structure
électronique de la molécule.
– Peu d’informations structurales, mais utile pour étudier
les structures électroniques des molécules insaturées, et
pour mesurer l’étendu de leur insaturation.
– Employée surtout en analyse quantitative, se révèlent
très pratiques au niveau des dosages.
Allure des spectres UV-visible
absorption :
A
λ (nm)
λ max
Caractéristiques d’une bande d’absorption
– La position
– L’intensité
* En phase liquide les bandes d’absorption sont larges
* En phase gazeuse avec un appareil haute résolution les spectres
présentent une structure fine de rais.
Absorbance en fonction de la longueur d’onde
λ.
Les spectres UV-visibles sont continus et constitués de bandes larges
Présentent un ou plusieurs maximum(s) d’absorbance, auquel correspond
une longueur d’onde notée
λmax, caractéristique d’un certain motif de
délocalisation des électrons.
Plusieurs molécules peuvent
présenter le même spectre.
π π*
n π*
Permet d’observer les transitions :
déceler la présence de liaisons π
C C
H3C
H3C CH3
CH3
C O
H3C
H3C
C C
C
C
CH3
H3C
H3C
H3C CH3
CH3
C C
O
C
CH3
H3C
H3C
CH3
π π*
π π*
n π*
π π*
π π*
n π*
175 nm
280 nm
185 nm
220 nm
320 nm
220 nm
La spectrophotométrie UV- visible est largement appliquée à
l’analyse quantitative.
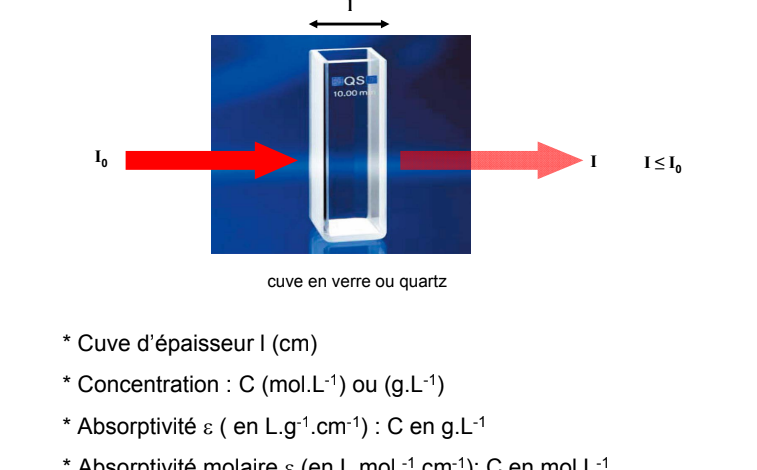
Loi de Beer – Lambert A = log (I
o / I) =
. l . c
Transmission : T = I/I
0
Absorbance : A = log10 1/T = log I
0 / I
L’absorbance UV-vis, dans certaines conditions, est fonction
de la concentration suivant la loi de Beer-Lambert :
ε est le coefficient d’extinction à une longueur d’onde
donnée, pour une famille de composés donnée.
l est le trajet optique.
C est la concentration de la solution étudiée)
I0 I
l
cuve en verre ou quartz
I ≤ I0
* Cuve d’épaisseur l (cm)
* Concentration : C (mol.L-1) ou (g.L-1)
* Absorptivité ( en L.g-1.cm-1) : C en g.L-1
* Absorptivité molaire (en L.mol -1.cm-1): C en mol.L-1
Cette relation de proportionnalité n’est vraie que dans certaines conditions :
– lumière monochromatique
– concentration pas trop élevée < 0.01M
– pas de fluorescence ni d’hétérogénéité
– la substance ne doit pas donner lieu à des réactions chimiques
sous l’effet du rayonnement incident
– la substance ne doit pas donner lieu à des associations variables
avec le solvant
Quand une onde électromagnétique est absorbée par un échantillon,
l’intensité de l’onde absorbée est proportionnelle à l’épaisseur de
l’échantillon, au nombre de molécules absorbantes par unité de
volume et à un coefficient propre à l’échantillon de matière.
Ce sont des transitions des électrons des orbitales
moléculaires liantes ou non liantes remplies vers des orbitales
anti-liants non remplies.
Transitions électroniques
OM
anti-liante
liante
S0: état fondamentale
E = h
S1: état excitée
10-8 10-9
s
n
Energie
* E élevée, il faut exciter à < 150nm
n * E moins élevée, excitation possible de 150 à 250nm
* : 1000 – 10000 cm-1L mol-1
n * : 10 – 100 cm-1L mol-1
E plus faible, de 180 à
270 nm
*
n *
*
n *
anti-liante
anti-liante
non-liante
liante
liante
Différents types de transitions possibles
Intensité de l’absorption
n
n
C
O
n
Systèmes conjugués multiples,
hydrocarbures aromatiques
substitués
très forte > 20000
Systèmes conjugués simples:
Diènes, cétone -insaturés,
hydrocarbures aromatiques
substitués
forte 10000-20000
moyenne 1000-1000 hydrocarbures aromatiques
faible 10-100
(l.mol transition chromophore -1.cm-1 Intensité
)
Un chromophore est une fonction ou un groupe d’atomes qui modifient la
fréquence de l’onde ainsi que l’intensité d’absorption (ε).
– Effet bathochrome : le chromophore diminue la fréquence d’absorption
(augmente le λ max). Déplacement de l’absorption vers des longueurs
d’ondes plus grandes dû à une substitution ou à un effet de solvant.
– Effet hypsochrome : le chromophore augmente la fréquence d’absorption
(diminue le λ max). Déplacement de l’absorption vers des longueurs
d’ondes plus courtes dû à une substitution ou à un effet de solvant.
– Effet hypochrome : le chromophore diminue l’intensité d’absorption
(diminue ε).
– Effet hyperchrome : le chromophore augmente l’intensité d’absorption
(augmente ε).
Effet bathochrome :
Quand on ajoute une conjugaison, la longueur d’onde d’absorption
augmente.
La délocalisation du nuage π va abaisser l’énergie.
C C
O
C
CH3
H3C
H3C
CH3
C C
+
O
–
C
CH3
H3C
H3C
CH3
C C
O
–
C
+
CH3
H3C
H3C
CH3
Plus il y a de délocalisations et plus la molécule sera
stable.
Si on ajoute une délocalisation supplémentaire, on déplace le spectre vers
les grandes longueurs d’ondes.
ε (l cm-1 mol-1)
1 C=C 2 C=C non conjuguées 2 C=C conjuguées
10 000 20 000 21 000
λmax (nm) 184 185 217
Effet hyperchromique : Pour des liaisons non conjuguées, la valeur est
simplement proportionnel au nombre de liaisons doubles, pour des liaisons
conjuguées, on observe une augmentation importante d’ε.
– Effet bathochromique : La conjugaison des Liaisons déplace le maximum
d’absorbance vers des longueurs d’onde plus élevées.
Plus la délocalisation sera importante, plus ε et λmax seront importants.
OH
O
OH
O
1 : 5 formes limites 2 : 6 formes limites
E2 < E1 et λ2 > λ Effet bathochrome : 1
UV-visible va permettre de vérifier la présence de double liaisons
et des conjugaisons.
Suivre une réaction ou déterminer une cinétique si les produits
absorbent dans l’UV ou le visible.
Caractéristique d’absorption des composés organique
Composés ne contenant que des liaisons
Grande stabilité des liaisons
L’énergie pour est environ cal.mol-1
L’excitation nécessite une énergie correspondant à l’UV lointain < 180 nm
Les hydrocarbures saturés sont transparents dans la région
de l’UV proche
solvants
Hexane max = 135 nm
Composés contenant des électrons n
Les électrons n ne forment pas de liaison, ils ne leur correspond pas d’orbitale
antiliante, ils peuvent subir deux types de transitions.
n
n
Composés saturés contenant des électrons n
Transition
n
Composés contenant des hétéroatomes, tel que O, S, N, X
La transition requiert moins d’énergie que la transition
Domaine 170 à 250 nm
solvants
Composés contenant des chromophores à électrons
Molécules comportant un hétéroatome porteur d’un doublet libre et
appartenant à un système insaturé.
Transition
n
Probabilité faible peu intense
Intérêt pour les aldéhyde et les cétones 3 bandes
n
n
Vers 150 nm intense
Vers 190 nm
faible 270 – 285 nm cétone
280 – 300 nm aldéhyde
bande R
< 30
Quand la polarité du solvant augmente le
max de la bande R baisse
C
O
Hexane
279 nm
Eau
264,5 nm
Transition
Les électrons sont mois fortement lies et sont donc plus aisément
excitable par le rayonnement.
Transitions très sensible à l’environnement
– Conjugaison
– la présence d’hétéroatome
Déplacement des maximas vers les plus grandes longueurs d’ondes
Les absorptions sont intense mais n’ont lieu dans un système C=C isolé
Qu’a des longueurs d’onde assez basses (l’UV lointain).
Éthylène
max = 165 nm
= 16000
L’intensité de l’absorption est indépendante du solvant
A cause de la nature non polaire de la liaison alcène
Une substitution par un groupement alkyle déplace l’absorption vers
des longueurs d’ondes plus grandes
Composés
max (nm) solvant
R CH CH
2
Oct-1-ène
177 heptane
C C
R
H
H
R
(Z) Oct-2-ène
179 Hexane
C C
R
R
H
H
(E) Oct-2-ène
183 Hexane
C C
R
R
H
R
2-méthylpent-2-ène
192 heptane
Composés
max (nm) solvant
R CH CH
2
Oct-1-ène
177 heptane
C C
R
H
H
R
(Z) Oct-2-ène
179 Hexane
C C
R
R
H
H
(E) Oct-2-ène
183 Hexane
C C
R
R
H
R
2-méthylpent-2-ène
192 heptane
Composés
max (nm) solvant
R CH CH
2
Oct-1-ène
177 heptane
C C
R
H
H
R
(Z) Oct-2-ène
179 Hexane
C C
R
R
H
H
(E) Oct-2-ène
183 Hexane
C C
R
R
H
R
2-méthylpent-2-ène
192 heptane
Composés
max (nm) solvant
R CH CH
2
Oct-1-ène
177 heptane
C C
R
H
H
R
(Z) Oct-2-ène
179 Hexane
C C
R
R
H
H
(E) Oct-2-ène
183 Hexane
C C
R
R
H
R
2-méthylpent-2-ène
192 heptane
La liaison avec un hétéroatome portant une paire d’électron libre
conduit à un effet bathochrome.
max = 228 nm (
8000)
Si plusieurs liaison isolée, la molécule absorbe à la même fréquence
que le chromophore isolé.
L’intensité de l’absorption est proportionnelle au nombre de chromophore
isolé
Diènes conjuguées
165 nm 217 nm
C C
C C
Le recouvrement crée 2 niveaux énergétiques supplémentaires.
Effet bathochrome
Une conjugaison plus étendu dans les polyènes à chaîne ouverte
Effet bathochrome
Les spectres des polyènes sont caractérisés par une structure fine,
particulièrement en phase gazeuse ou dans des solvants polaires.
But-1,3-diène
max = 217nm
Hex-1,3,5-triène
max = 245nm
H3C
CH3
H
n
n = 1 174 1,6 10-4
n = 2 227 2,4 10-4
n = 3 275 3 10-4
n = 4 310 7,7 10-4
n = 5 342 12,2 10-4
n = 6 380 14,7 10-4
max
Le chromophore carbonyle
C
O
n
n
n
Vers 150 nm intense
Vers 190 nm
faible 270 – 285 nm cétone
280 – 300 nm aldéhyde
bande R
< 30
La nature du solvant influe sur la position de la bande d’absorption
Quand la polarité du solvant augmente effet hypsochrome
C
H
3
C
H
3
C
O Hexane
279 nm
Eau
264,5 nm
L’effet hypsochrome avec l’eau résulte de la liaison hydrogène qui baisse
l’énergie de l’orbitale n.
Ce déplacement peut être utilisé pour mesuré la force de la liaison hydrogène.
Valeurs d’absorption pour des cétones et aldéhydes saturée
n
Transition
Composés
max (nm)
max solvant
Acétone 279 13 isooctane
Ethyle méthyle cétone 279 16 isooctane
Diisobutyle cétone 288 24 isooctane
Hexaméthylacétone 295 20 alcool
Cyclopentanone 299 20 hexane
Cyclohexanone 285 14 hexane
Acétaldéhyde 290 17 isooctane
Propionaldéhyde 292 21 isooctane
Isabutyraldéhyde 290 16 hexane
L’introduction d’un halogène en
dans une cétone aliphatique à peu
d’effet sur
n
Par contre
O
X
CO -5 +10
2CH
3
OH -12 +17
Br -5 +28
Cl -7 +22
X eq ax
O
285 nm dans l’hexane
Effet bathochrome
Effet utilisé dans la détermination de la structure des stéroïdes et des
terpènes halogénés
Valeurs d’absorption de composés contenant un carbonyle
n
Composés
max (nm)
max solvant
acétaldéhyde 293 11,8 hexane
acide acétique 204 41 éthanol
acétate d’éthyle 207 69 éther de pétrole
acétamide 220 20 eau
chlorure d’acétyle 235 35 hexane
anhydride acétique 225 47 isooctane
acétone 279 15 hexane
Les aldéhydes et cétone conjugués
,-insaturés
énone
212 à 215 nm
= 10000 à 20000
n
310 à 350 nm Pas tj observable du fait de la
largeur de la bande
*
Surtout dans les solvants polaires
n
eau 242,6 Caché sous la bande K
chlorofome 237,6 314
isooctane 230,6 321
K
R
Composés aromatiques
Le benzène présente 3 bandes caractéristiques
184 nm = 60000 bande E1
204 nm = 7900 bande E2
256 nm = 200 bande B
Bande B :
– structure fine
– effet bathochrome si substitution par groupement alkyle,
ou par groupe auxochrome (OH, NH2,…)
Chlorobenzène 258 2,13 Ethanol
Ion anilinium 254 2,18
Aniline 284 3,27 Ethanol
Éthoxybenzène 271 3,23 Hexane
Ion phénate 287 3,41
Phénol 271 3,28 Ethanol
composés max Lg solvant
Absorption de quelques dérivés substitués du benzène
OH-
OH O-
Effet bathochrome sur les bandes E2 et B
Augmentation de a cause des électrons non liants de l’anion, disponibles
pour interagir avec le cycle.
H+
NH2 NH3+
Spectre quai identique à
celui du benzène
Effets du aux solvants : solvatochromie
H
3
C
C
O
CH
3
H
2O CH
3OH C
2
H
5OH CHCl
3
C
6
H12
264,5 270 272 277 279
L’augmentation de la polarité du solvant s’accompagne, en général, d’un
effet bathochrome pour les transitions π π* et d’un effet
hypsochrome (déplacement vers des longueurs d’ondes plus faibles)
pour les transitions n
π*.
L’Interactions soluté/solvant entraîne une modification des niveaux
d’énergie
Modification de la position , de l’intensité et de la forme des bandes
Exemple des cétones : Liaisons H avec C=O : n et
* sont abaissés
Transition n
* : plus énergétique (effet hypsochrome)
Transition * : moins énergétique (effet bathochrome)
Influence de l’environnement
I) Transition et mésomérie
Écrasement progressive de la transition * lors de
l’augmentation de la conjugaison
Il est possible de moduler le
max d’une molécule à sa guise
bronzage UV 320 – 350 nm
Erythem UV 280 – 320 nm
Écran solaire : chromophore absorbant entre 280 et 320 nm
N
OEt
O
H
3
C
H
3
C CH
2 , CHOHCH
2OH
II) Transition * et effet stérique
La perte de la coplaneîté d’un système conjugué réduit la mésomérie
Effet hypsochrome
H H
H 245
F 234 60°
Cl 230 74°
Br 228 75°
I absente 79°
Applications aux études d’équilibre
Tautomérie céto-énolique
Y
Z
O
Y
Z
OH
Si Y=Z a un effet -M équilibre vers l’énol
Dans l’acétone
n
* 290 nm
Dans l’énol (système conjugué)
* 230 nm
Règles de Woodward-Fieser et Scott
Corrélation entre structure et position des maximas d’absorption
– carbonylés
,-insaturés
– diènes conjugués
– carbonyles aromatiques
On peut prévenir la position de la bande d’absorption *des
systèmes conjugués
Basés sur l’addition d’incréments caractéristique à des valeurs de bases
X
O
R
R = H
R = alkyle ou reste de cycle
R = OH, OR 230 nm
246 nm
250 n
m
*Analyse fonctionnelle
Détection des groupements chromophores
*bande de faible intensité à 280-290nm
*déplacement vers des faibles l dans un solvant polaire
*bande de faible intensité à 260nm
*structure fine
*Comparaison des effets du pH avec les
spectres du phénol et de l’aniline
Applications: Analyse qualitative
C=O
C6H6
– amine aromatique
– phénol
Conclusion
– courtes longueurs d’ondes pour les excitations les plus énergétiques
– plus grandes longueurs d’ondes pour les transitions les plus aises
– l’absorption augmente en général en intensité lorsqu’on se déplace
vers les courtes longueurs d’ondes
– les systèmes conjugués qui absorbent de la lumière dont la longueur
d’onde est supérieur à 400 nm sont colorés :
transition de 450 nm molécules orangées
transition de 550 nm molécules violettes
transition de 650 nm molécules verdâtres
Plus il y a de dl conjuguées plus la transition * est facile est intense,

